Natural Bond Orbital (NBO) Analysis, 自然軌道解析をやってみる
中心金属と配位子の間の結合次数が知りたい!
しかし、量子化学計算結果を見ても、分子軌道として表示されているので個別のM–L相互作用についてはあんまり良くわかりません。
こんなときに、実験化学者を助けてくれるのが、NBOです。
名城大、永田先生が、メタンを例にわかりやすい図を示されています。
これを見て、なんのこっちゃ?という人は、無機化学の教科書の分子軌道や、対称適合線形結合のところを勉強しましょう。[ハウスクロフト無機化学が、まだ割とわかりやすいように思います。]
しかし、量子化学計算結果を見ても、分子軌道として表示されているので個別のM–L相互作用についてはあんまり良くわかりません。
こんなときに、実験化学者を助けてくれるのが、NBOです。
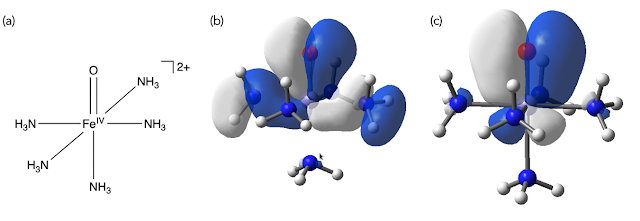
[Fe(IV)(O)(NH3)5]2+ 錯体 (a) と、そのFe–O間のπ結合に相当するMO (b) と, NBO (c)
MOでは、アンモニアにまで軌道が染み出しているのに対し、NBOではそのような染み出しができる限り抑えられており、鉄中心と酸素配位子の間の電子密度に焦点があたっているのがわかる。
これを見て、なんのこっちゃ?という人は、無機化学の教科書の分子軌道や、対称適合線形結合のところを勉強しましょう。[ハウスクロフト無機化学が、まだ割とわかりやすいように思います。]
Wisconsin大Madison校、フランク・ワインホルド博士が1980年代に開発した手法で、彼のNBOについての総説は2019年現在、むちゃくちゃ引用されています。
この総説を参考にざっくりと説明すると、NBO解析の手順は以下のとおりです。
0. まず、分子軌道をいつもどおりに計算します。
1. 続いて、得られた分子軌道を構成する原子軌道を切り出します。ここで、それぞれの原子軌道は、直行関係をもつように計算されています。
2. 更に、有機化学の教科書にあるような形で混成させることで、 自然混成軌道(NHO)を作ります。(sp3混成ってやりましたよね。あれです。)
3. 最後にこれらを線形結合させることで、2原子間の結合をシンプルに(あるいは我々の結合の見立てと合致する形で)記述する自然結合軌道(NBO)を生成します。
一旦、たくさんの関数の足し合わせとして求まった分子軌道を、再び原子軌道へと切り分けるところが、解析手法のミソ。
良く分からなければ、とりあえず結合論で学習する、混成軌道を利用した分子の組み立てをやっていると考えれば良いと思います。
この総説を参考にざっくりと説明すると、NBO解析の手順は以下のとおりです。
0. まず、分子軌道をいつもどおりに計算します。
1. 続いて、得られた分子軌道を構成する原子軌道を切り出します。ここで、それぞれの原子軌道は、直行関係をもつように計算されています。
2. 更に、有機化学の教科書にあるような形で混成させることで、 自然混成軌道(NHO)を作ります。(sp3混成ってやりましたよね。あれです。)
3. 最後にこれらを線形結合させることで、2原子間の結合をシンプルに(あるいは我々の結合の見立てと合致する形で)記述する自然結合軌道(NBO)を生成します。
一旦、たくさんの関数の足し合わせとして求まった分子軌道を、再び原子軌道へと切り分けるところが、解析手法のミソ。
良く分からなければ、とりあえず結合論で学習する、混成軌道を利用した分子の組み立てをやっていると考えれば良いと思います。
原子軌道 → 自然原子軌道(NAO) → 自然混成軌道(NHO) →自然結合軌道(NBO) → 自然局在化分子軌道(NLMO)→ 分子軌道 の順に、原子軌道がミキシングされて行きます。
このNBO法は、すっかり市民権を確認しており、Gaussianでもサポートされています。ただ、こまかい設定をするには、独自の文法が必要になります。
解説サイトをいくつか引用しておきます。
コンフレックス: GaussianViewからの設定(一番初歩的)[ページ内をNBOで検索]
HPCシステムズのGaussianマニュアル和訳
計算科学.comの解説
Gaussian Inc.から見られるオフィシャルのマニュアル(英語)
この方法を使った、金属錯体の価数評価の記事も書きました。
興味があれば、そちらもどうぞ。自然軌道解析(NBO解析)による錯体の価数の決め方
NPAがどのような手続きを経ているのか、理解の一助となる、元分子研教授岩田先生のページ
解説サイトをいくつか引用しておきます。
コンフレックス: GaussianViewからの設定(一番初歩的)[ページ内をNBOで検索]
HPCシステムズのGaussianマニュアル和訳
計算科学.comの解説
Gaussian Inc.から見られるオフィシャルのマニュアル(英語)
この方法を使った、金属錯体の価数評価の記事も書きました。
興味があれば、そちらもどうぞ。自然軌道解析(NBO解析)による錯体の価数の決め方
計算化学をやっている方にはおなじみだと思いますが、たとえば3-21G規底で計算すれば、炭素原子は1s2s2px2py2pz軌道に加えて、更にs軌道とp軌道のセットを付け加えて計算が行われます(参考:名古屋市立大計算機センター)。分子軌道は、これらの混ざりとして計算されているので、我々が初等の化学結合論で習うものよりも、複雑な形で表現されます。
原子軌道を表現する最小の軌道に加えて、さらに関数を加えてやることで、微妙に対称性が下がった軌道などが表現できます。これは、連続な曲線が、多項式の次数を挙げることで近似できること(テイラー展開)や、波が三角関数の足し合わせで表現できること(フーリエ級数展開 [参照 長沼伸一郎: 物理数学の直感的方法])と似ています。


コメント
コメントを投稿